Diklofenak w praktyce fizjoterapeuty: Co musisz wiedzieć, zanim polecisz pacjentowi?
Diclofenac in the practice of a physiotherapist: What do you need to know before recommending to a patient?

Spis treści:
Wprowadzenie
Bólem nazywane jest nieprzyjemne doznanie czuciowe i emocjonalne związane z aktualnym lub potencjalnym uszkodzeniem tkanek. Ostry ból, będący konsekwencją uszkodzenia tkanek, pełni rolę ostrzegawczą i ochronną. Ból przewlekły traci swoją ostrzegawczo-obronną funkcję, przynosi pacjentowi cierpienie i sam w sobie staje się chorobą. Optymalną metodą uwolnienia pacjenta od bólu jest usunięcie jego przyczyny, jednak nie zawsze jest to możliwe. Nawet jeżeli leczenie przyczynowe może zakończyć się powodzeniem, podczas jego trwania, równolegle z postępowaniem przyczynowym, zazwyczaj należy stosować leczenie zmniejszające lub usuwające ból. Do powszechnie akceptowanych, skutecznych metod zwalczania bólu należy farmakoterapia. Dobór leku przeciwbólowego zależy m.in. od przyczyny bólu, jego lokalizacji, nasilenia i czasu trwania. W wielu przypadkach, szczególnie w bólach mięśniowo-szkieletowych różnego pochodzenia, zwłaszcza gdy towarzyszy im stan zapalny, skuteczne jest stosowanie leków z grupy niesteroidowych leków przeciwzapalnych (NLPZ). Znanym od dawna i często stosowanym NLPZ jest diklofenak – lek o stosunkowo silnym działaniu przeciwzapalnym i przeciwbólowym. Lek ten został wprowadzony na rynek w 1973 roku, a od 1985 roku jest dostępny w preparatach do stosowania miejscowego – często równie skutecznych jak preparaty stosowane ogólnoustrojowo, ale obarczonych znacznie niższym ryzykiem ogólnoustrojowych działań niepożądanych. Miejscowo można stosować diklofenak do miejscowego objawowego łagodzenia ostrego bólu, stanu zapalnego i obrzęku. Wskazane jest dobrać odpowiednią postać leku dla wskazania, a w którym lek jest stosowany [1-7].
W Polsce diklofenak jest dostępny do stosowania miejscowego w postaci [8]:
- Żelu o stężeniu substancji czynnej 1% i 2%;
- Aerozolu na skórę o stężeniu substancji czynnej 4%;
- Plastrów przezskórnych zawierających 140 mg diklofenaku
Tabela 1. Dobór postaci diklofenaku do wskazania, w którym lek jest stosowany
| Postać leku | Wskazania do stosowania wymienionej postaci leku | Wiek pacjenta |
| Żel | Pourazowe stany zapalne ścięgien, więzadeł, mięśni i stawów | Dorośli i młodzież > 14 lat |
| Ból pleców | ||
| Ograniczone stany zapalne tkanek miękkich (zapalenie ścięgien, łokieć tenisisty, zapalenie torebki stawowej, zapalenie okołostawowe) | ||
| Miejscowe leczenie ograniczonych i łagodnych postaci choroby zwyrodnieniowej stawów | Dorośli > 18 lat | |
| Plastry przezskórne | Ostre nadwyrężenia, zwichnięcia kończyn, skręcenia, stłuczenia | Dorośli i młodzież > 16 lat |
| Aerozol | Miejscowe, objawowe leczenie bólu o nasileniu łagodnym do umiarkowanego | Dorośli i młodzież > 14 lat |
Mechanizm działania diklofenaku
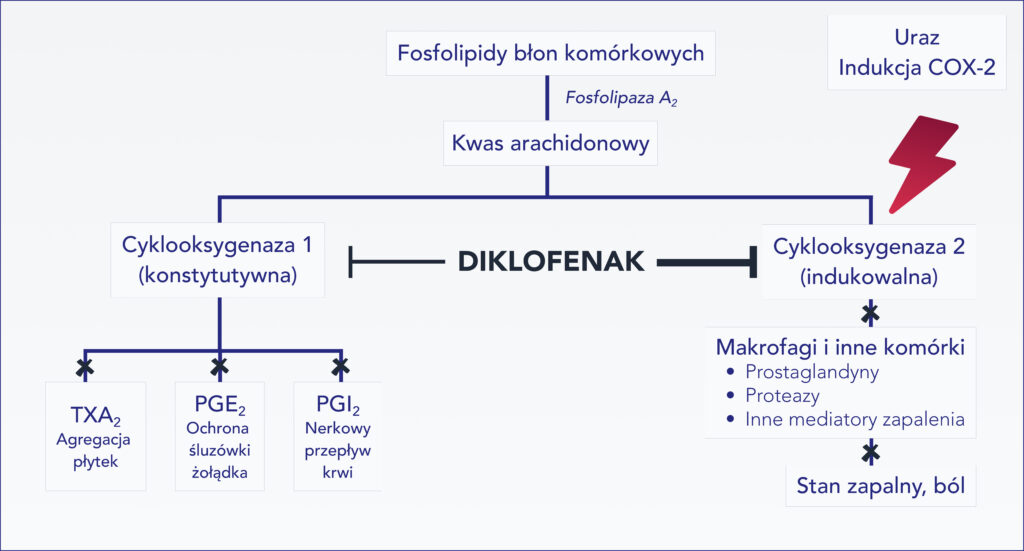
Podobnie jak w przypadku innych NLPZ, główny mechanizm działania diklofenaku polega na hamowaniu aktywności cyklooksygenazy – enzymu odpowiedzialnego za syntezę prozapalnych eikozanoidów z kwasu arachidonowego.
Rycina 1 Podstawowy mechanizm działania diklofenaku
Enzym ten ma dwie izoformy – COX-1 i COX-2. COX-1 jest enzymem konstytutywnym, obecnym w większości tkanek, biorącym udział w ich fizjologicznej aktywności. Szczególnie istotną rolę odgrywa w płytkach krwi (uczestniczy w ich aktywacji podczas procesu krzepnięcia), w nerkach (reguluje nerkowy przepływ krwi) oraz błonie śluzowej żołądka (bierze udział w jej ochronie przed uszkodzeniem przez kwa solny). COX-2 w warunkach fizjologicznych jest obecna w tkankach w niewielkiej ilości (COX-2 konstytutywna; np. w układzie krążenia i nerkach), a jej ekspresja znacznie wzrasta w razie uszkodzenia tkanek (10-80-krotnie) – syntetyzowane wówczas prostaglandyny (głównie PGE2, działająca za pośrednictwem receptorów EP1 i EP2) biorą udział w procesie zapalnym i powstawaniu bólu [9, 10].
Większość NLPZ w różnym stopniu hamuje aktywność obu izoenzymów, przy czym hamowanie COX-2 jest związane z ich działaniem terapeutycznym, zaś hamowanie COX-1 odpowiada za większość działań niepożądanych tej grupy leków (część działań niepożądanych wynika z hamowania konstytutywnej COX-2). Diklofenak ok. 4-krotnie silniej hamuje COX-2 niż COX-1, dzięki czemu, w porównaniu z innymi NLPZ, rzadko powoduje działania niepożądane w obrębie przewodu pokarmowego (przy stosowaniu ogólnoustrojowym) [11].
Hamowanie aktywności COX-2 jest uznawane za główny mechanizm przeciwbólowego i przeciwzapalnego działania diklofenaku, nie jest to jednak mechanizm jedyny. Diklofenak dodatkowo hamuje sensyntyzację nocyceptorów poprzez mechanizm związany z tlenkiem azotu i otwieraniem kanałów potasowych na neuronach nocyceptywnych, a także hamuje aktywność kanałów sodowych ASIC3 (acid-sensing ion channels) na neuronach czuciowych. Złożony mechanizm działania diklofenaku zwiększa skuteczność jego działania przeciwbólowego w bólu ostrym jak i przewlekłym. [9, 12-15].
Zastosowanie NLPZ, w tym diklofenaku, ma szczególne znaczenie w hamowaniu procesu zapalnego w obrębie przyczepów ścięgnistych (np. w zapalenie nadkłykcia bocznego kości ramiennej). Niekontrolowany stan zapalny w obrębie entez może doprowadzić do nieodwracalnych zmian destrukcyjnych. NLPZ nie tylko pozwalają złagodzić objawy kliniczne, ale także zapobiegają nieodwracalnym zmianom. W schorzeniach należących do tej grupy NLPZ są skuteczniejsze niż w stanach zapalnych błony maziowej, co sugeruje dominująca rolę PGE2 w zapaleniach entez. Ponad to, ponieważ PGE2 jest silnym induktorem osteoblastów, NLPZ mogą hamować kostnienie przyczepów ścięgnistych [16].
Skuteczność diklofenaku stosowanego miejscowo
Preparaty diklofenaku przeznaczone do stosowania miejscowego pozwalają na działanie terapeutyczne, a równocześnie minimalizację ogólnoustrojowych działań niepożądanych. Jednakże po zaaplikowaniu na skórę, aby dotrzeć do znajdujących się głębiej tkanek będących miejsca działania, lek musi pokonać przede wszystkim pokonać barierę, jaką stanowi skóra, a zwłaszcza warstwa rogowa naskórka. Mechanizm penetracji leków aplikowanych miejscowo jest słabo poznany i prawdopodobnie proces ten zachodzi kilkoma drogami [10, 17]:
Diklofenak charakteryzuje się właściwościami, które umożliwią sprawny transport przez skórę i preferencyjne rozmieszczanie w tkankach objętych stanem zapalnym [10, 17-19]:
- tworzenie rezerwuaru leku w powierzchownych tkankach – diklofenak, zaaplikowany na skórę, może gromadzić się w warstwie rogowej naskórka, skórze i tkance podskórnej, tworząc rodzaj rezerwuaru, z którego jest powoli uwalniany, co przedłuża jego miejscowe działanie (powstawaniu takiego rezerwuaru sprzyjają dobra rozpuszczalność diklofenaku zarówno w wodzie jak i w tłuszczach, oraz jego duża skłonność do wiązania z białkami);
- niewielka masa molowa – przez skórę najłatwiej przechodzą małe cząsteczki, o masie molowej < 500 g/mol, zatem diklofenak o masie 296 g/mol łatwo dociera do miejsca działania;
- amfifilowy charakter cząsteczki – diklofenak jest słabym kwasem (pKa 3,9), dobrze rozpuszczalnym zarówno w środowisku wodnym jak i hydrofobowym, co ułatwia jego penetrację do głębiej położonych tkanek;
- duża zdolność do wiązania z białkami (w osoczu 99% leku jest związane z albuminami) i łatwe dysocjowanie od nich w środowisku o niskim pH, typowym dla miejsc objętych stanem zapalnym. Ułatwia to koncentrację diklofenaku w płynie maziowym i tkankach okołostawowych objętych stanem zapalnym, gdzie stężenie albumin jest wyższe niż w tkankach zdrowych, a więc i lek osiąga stężenie wyższe niż w osoczu. Właściwość ta wydłuża czas miejscowego działania diklofenaku – po podaniu doustnym okres półtrwania leku w osoczu wynosi 1-2 godziny, podczas gdy w uszkodzonych tkankach utrzymuje się on się nawet do 12 godzin po podaniu;
- podleganie efektowi „pułapki jonowej”, dzięki czemu w miejscach objętych stanem zapalnym łatwo wnika do komórek będących jego miejscem działania i gromadzi się wewnątrz komórek (diklofenak jest słabym kwasem, zatem w środowisku o niskim pH dominuje jego forma niezdysocjowana, łatwo przechodząca przez błony komórkowe, natomiast w komórkach podlega dysocjacji, co utrudnia opuszczenie komórki).
Transportowi diklofenaku do głębszych warstw skóry sprzyjają zawarte w preparatach do stosowania miejscowego substancje pomocnicze, które zmiękczają naskórek. Roztwór, aplikowany w aerozolu, zawiera łatwo parujące składniki alkoholowe – po ich odparowaniu wzrasta lepkość preparatu, który przybiera konsystencję żelu i lepiej przywiera do skóry. Ponad to zwiększa się stężenie diklofenaku, co ułatwia jego wnikanie do głębiej położonych tkanek. Wodno-alkoholowe podłoże żelu i aerozolu ma dodatkowo działanie kojące i chłodzące [1-5, 20, 21].
Transport leku do miejsca działania ułatwia delikatne wmasowanie preparatu w skórę oraz regularne powtarzanie aplikacji (stężenie diklofenaku w płynie maziowym, po jednorazowej aplikacji jest ok. 5-krotnie wyższe niż w osoczu, podczas gdy w stanie stacjonarnym – po 8 dniach stosowania – 7-krotnie wyższe niż w osoczu). Leki stosowane miejscowo łatwiej docierają do stawów położonych płytko pod skórą – np. staw kolanowy, barkowy, skokowy czy stawy rąk, stąd skuteczność NLPZ w leczeniu bólu i stanu zapalnego w urazach i chorobach tych stawów jest większa, niż w przypadku stawów położonych głęboko, jak np. staw biodrowy [17]. Badanie przeprowadzone na zdrowych ochotnikach wykazało, że po 10-krotnie powtarzanej aplikacji na skórę uda aerozolu zawierającego 4% diklofenaku (w ciągu 3 dni) stężenie leku w mięśniach uda było podobne lub wyższe niż po podawaniu doustnym przez 3 dni (150 mg/doba w 3 dawkach podzielonych). Jednocześnie stężenie diklofenaku w osoczu było ok. 10-krotnie niższe po aplikacji miejscowej niż po podaniu doustnym. Odnotowano także, że po miejscowym zastosowaniu leku zarówno maksymalne stężenie w tkankach jak i w osoczu wykazywało znaczną osobniczą zmienność – prawdopodobnie był to skutek osobniczo zmiennego ukrwienia w miejscu aplikacji, zmienności w przepływie krwi spowodowanych poruszaniem się i różnic w przepuszczalności warstwy rogowej naskórka [20]. Stężenie diklofenaku stosowanego miejscowo badano nie tylko w mięśniach, ale również w płynie maziowym i błonie maziowej stawów kolanowych. Pacjenci z chorobą zwyrodnieniową kolan, przygotowywani do zabiegu wymiany stawu kolanowego, aplikowali sobie diklofenak (w postaci 4% aerozolu) na skórę chorego kolana, a następnie delikatnie wmasowywali w skórę. Pojedyncza dawka aerozolu zawierała 40 mg leku i była aplikowana przez 3 dni co 12 godzin lub co 8 godzin. Próbki płynu maziowego, błony maziowej i osocza, w których następnie badano stężenie leku, były pobierane 8 godzin po ostatniej aplikacji, podczas zabiegu operacyjnego. Wykazano, że stężenie diklofenaku było znacznie wyższe w tkankach objętych stanem zapalnym niż w osoczu, a ponad to stwierdzono dużą osobniczą zmienność we wchłanianiu leku (podobnie jak w przywołanym wcześniej badaniu – Brunner i wsp., 2005) [21].
Do częstych bolesnych dolegliwości układu ruchu należy zapalenie nadkłykcia bocznego kości ramiennej, czyli tzw. łokieć tenisisty. Wbrew nazwie, schorzenie to dotyczy nie tylko osób grających w tenisa czy squasha, ale także korzystających przez dłuższy czas z komputera, a także innych, które wielokrotnie wykonują ruchy prostowania i rotacji nadgarstka – m.in. stomatologów, lekarzy specjalizacji zabiegowych, elektryków, murarzy, ślusarzy czy pracowników budowlanych. Dolegliwość ta może występować u 1-3% osób dorosłych. W kilku badaniach, obejmujących łącznie kilkaset osób wykazano, że stosowany miejscowo diklofenak (w postaci 1-2% żelu), zmniejszał nasilenie bólu przy wykonywaniu ruchów oraz zapotrzebowanie na doustne leki przeciwbólowe, a także zwiększał średnią siłę chwytu i zmniejszał stopień upośledzenia funkcji ręki. Nie występowały przy tym ogólnoustrojowe działania niepożądane (żołądkowo-jelitowe ani sercowo-naczyniowe), a niepożądane efekty miejscowe były niezbyt częste i zwykle łagodne [22].
Skuteczność przeciwbólowego i przeciwzapalnego działania aerozolu zawierającego 4% diklofenaku badano w przypadkach ostrego bólu, u pacjentów z niepowikłanym skręceniem stawu skokowego. Było to wieloośrodkowe badanie obejmujące ponad 200 osób, z których połowa aplikowała na skręcony staw aerozol zawierający diklofenak, a połowa aerozol z placebo (3 razy na dobę, co 7-8 godzin). Badanie trwało 14 dni od momentu urazu. W grupie aplikującej diklofenak szybciej ustępował obrzęk kostki (różnica była statystycznie istotna po 10 dniach),a osoby leczone diklofenakiem odczuwały słabszy ból przy spontanicznych ruchach przez cały czas trwania badania, niż osoby stosujące placebo [23].
Zastosowanie diklofenaku w jonoforezie i fonoforezie
Penetrację diklofenaku, stosowanego miejscowo, do miejsca działania można nasilić, a zatem poprawić skuteczność działania leku stosując go wraz z zabiegiem jono- lub fonoforezy. Roztwory diklofenaku wykorzystywane do jonoforezy powinny mieć stężenie takie, jak przy podawaniu leku we wstrzyknięciach (25 mg/ml). Elektrodą czynną jest w przypadku stosowania diklofenaku katoda. W badaniach na zwierzętach wykazano, że w jonoforeza zwiększa penetrację diklofenaku (szczególnie w postaci soli sodowej) przez skórę o ok. 50 % w porównaniu do biernej dyfuzji. Podobnie jak w przypadku konwencjonalnego stosowania leku, również podczas jonoforezy tworzy się rezerwuar diklofenaku w warstwie rogowej naskórka, z którego następnie jest on transportowany do położonych głębiej tkanek za pośrednictwem miejscowego mikrokrążenia [24].
W porównaniu z konwencjonalną fonoforezą, w której na skórę stosowano tylko żel akustyczny, u pacjentów z chorobą zwyrodnieniową kolan, u których stosowano podczas zabiegu żel z 1% diklofenakiem (w postaci soli sodowej) stwierdzono istotnie większą skuteczność zabiegów w redukcji bólu i sztywności stawów oraz poprawę sprawności fizycznej. Ogrzewanie tkanki przez fale ultradźwiękowe ułatwia wnikanie leku do sieci naczyń włosowatych w skórze właściwej i leżących pod nią tkanek, zwłaszcza przez mieszki włosowe i gruczoły potowe [25]. Fonoforeza z zastosowaniem 2,5% żelu z diklofenakiem okazała się skuteczną metodą redukcji bólu w grupie 135 pacjentów z różnymi urazami i schorzeniami układu ruchu, u których 4-tygodniowa konwencjonalna rehabilitacja nie przyniosła znaczącej poprawy. W badanej grupie znaleźli się pacjenci z urazami stawów kończyn górnych i dolnych, tendinopatiami, bólem dolnej części pleców oraz po zabiegach operacyjnych dotyczących stawów. Stosowaniu przez 4 tygodnie fonoforezy z użyciem diklofenaku u większości pacjentów nasilenie bólu zmniejszyło się z 6-7 (w skali numerycznej od 0 do 10), do 2-3 w tej skali [26].
Działania niepożądane diklofenaku stosowanego miejscowo
Skuteczne działanie przeciwbólowe miejscowych preparatów zawierających diklofenak w stężeniu 1-4% potwierdzono wielokrotnie u pacjentów z chorobą zwyrodnieniową kolan. Lek skutecznie zmniejszał ból, zarówno spontaniczny jak i przy poruszaniu, zmniejszał sztywność stawów, a także poprawiał sprawność fizyczną. Stosowane miejscowo preparaty diklofenaku były dobrze tolerowane przez pacjentów – nawet po kilkunastu tygodniach regularnego stosowania częstość ogólnoustrojowych działań niepożądanych była podobna jak w grupach otrzymujących placebo. Miejscowe działania niepożądane, w miejscu aplikacji, były z reguły łagodne – u ok. 25% osób występowała suchość i uczucie pieczenia skóry, a u kilkunastu procent takie objawy jak zaczerwienienie skóry, świąd czy kontaktowe zapalenie skóry. W porównaniu z preparatami doustnymi działania te, nawet jeśli nieprzyjemne dla pacjentów, były łagodne i nie stanowiły dużego zagrożenia. Ponieważ przy stosowaniu miejscowym lek występuje w osoczu tylko w niewielkim stężeniu można go stosować u osób nietolerujących preparatów doustnych i pacjentów w podeszłym wieku [1-5, 18, 19].
Tabela 2 Porównanie najczęściej występujących działań niepożądanych diklofenaku przy podawaniu doustnym i stosowaniu miejscowym
| Podawania doustne (objawy występujące często ³ 1/100 do <1/10) | Stosowanie miejscowe |
| Dolegliwości żołądkowo-jelitowe (np. nudności, wymioty, biegunka, skurcze w jamie brzusznej, niestrawność, wzdęcia, brak łaknienia) | Często (³ 1/100 do <1/10) – wysypka, egzema, rumień, zapalenie skóry (w tym kontaktowe), świąd |
| Bóle głowy, uczucie oszołomienia, zawroty głowy | Rzadko (³ 1/10 000, do < 1/1000) – zapalenie skóry pęcherzowe |
| Wysypki i wykwity skórne | Bardzo rzadko (< 1/10 000) – nadwrażliwość (w tym pokrzywka), obrzęk naczynioruchowy, wysypka krostkowa, reakcje nadwrażliwości na światło, astma |
| Zwiększenie aktywności aminotransferaz w surowicy (AlAT, AspAT). | Częstość nieznana – reakcje w miejscu stosowania (sucha skóra, uczucie pieczenia) |
Fototoksyczność NLPZ
Miejscowe stosowanie NLPZ pozwala uniknąć ich ogólnoustrojowych działań niepożądanych – dotyczących przewodu pokarmowego, układu krążenia i nerek. Jednak ta metoda stosowania NLPZ w jest obarczona wyższym niż przy stosowaniu ogólnoustrojowym leku, ryzykiem wystąpienia reakcji nadwrażliwości na światło – prawdopodobnie ze względu na wyższe stężenie leku w skórze. Indukowaną przez leki nadwrażliwością na światło określa się nadmierne lub nieprawidłowe reakcje skóry na światło słoneczne u osób stosujących lek. Reakcje te można podzielić na fototoksyczne i fotoalergiczne – te pierwsze występują znacznie częściej [27, 28].
Reakcja fototoksyczna może wystąpić u każdej osoby narażonej na wystarczającą ilość energii świetlnej, podczas gdy w skórze obecny jest fotouczulacz. Fototoksyczność leków jest efektem ich przekształcania – po zaabsorbowaniu energii świetlnej – do toksycznych fotoproduktów, lub reaktywnych cząsteczek o krótkim okresie półtrwania, takich jak wolne rodniki. Lek może się stać obiektem reakcji fotochemicznej w skórze zarówno po zastosowaniu powierzchniowym jak i ogólnoustrojowym (gdy dociera do skóry drogą naczyń krwionośnych). Powstające w efekcie związki reagują z substratami biologicznymi, mogąc nasilać klasyczne reakcje skóry na światło słoneczne lub wywoływać odpowiedzi nietypowe. Reakcje fototoksyczne mogą wystąpić w okresie od kilku minut do nawet 20 godzin po ekspozycji na światło skóry, w której obecny jest fotouczulacz. Na skórze może pojawić się rumień, obrzęk, pęcherze, złuszczanie naskórka lub przebarwienia – przypominające nadmiernie nasilone oparzenia słoneczne. Pacjenci mogą odczuwać pieczenie skóry lub ból. Nasilenie objawów jest zależne od dawki fotouczulacza i intensywności światła słonecznego. Objawy dotyczą tylko miejsc eksponowanych na światło słoneczne i ustępują po przerwaniu ekspozycji na światło lub zaprzestaniu stosowania leku, jednak przebarwienie skóry może utrzymywać się przez kilka miesięcy. Fotoksyczność może być efektem peroksydacji lipidów i, w konsekwencji, niszczenia błon komórkowych lub uszkodzeń DNA. Zjawisko to można badać w układach biologicznych in vitro (np. zawiesina erytrocytów, hodowla hepatocytów, błony komórkowe, DNA) [27, 29].
Reakcje fotoalergiczne mają charakter nadwrażliwości typu opóźnionego, z udziałem limfocytów T. Ich wystąpienie wymaga wcześniejszego uczulenia i wykazuje okres utajenia – po ponownym podaniu leku i napromieniowaniu, reakcja skórna pojawiają się zazwyczaj po ok. 24-48 godzinach (okres utajenia może być dłuższy). Uważa się, że początkowym etapem fotoalergii jest wychwyt leku/fotohaptenu zaaplikowanego na skórę przez komórki prezentujące antygen w naskórku. Następnie dochodzi do migracji tych komórek drogą naczyń limfatycznych do lokalnych węzłów chłonnych, gdzie stymulują proliferację limfocytów T specyficznych dla antygenu [29]. Takie reakcje występują tylko u niektórych osób poddanych działaniu substancji fotoalergizującej i promieniowania UV. Zmiany skórne mają postać grudkowo-krostkowych wykwitów z towarzyszącym silnym świądem – są one określane jako fotoalergiczny wyprysk kontaktowy (fotoalergiczne kontaktowe zapalenie skóry; photoallergic contact dermatitis; PACD). Inaczej niż w przypadku reakcji fototoksycznych, efekt w niewielkim stopniu jest zależny od dawki leku, a zmiany mogą obejmować również nienapromieniowane obszary skóry. Ustąpienie objawów skórnych po odstawieniu leku zwykle trwa kilka tygodni, aczkolwiek może przedłużać się do kilku miesięcy. Zwykle nie pozostawiają długotrwałych przebarwień skóry. Fotoalergia może też mieć charakter uogólniony, po ogólnoustrojowym stosowaniu leku [27, 28, 30].
Reakcje fototoksyczne i fotoalergiczne mogą być indukowane przez wszystkie leki należące do NLPZ. Najczęściej są one obserwowane pod wpływem pochodnych kwasu propionowego – ketoprofenu i naproksenu, za co może odpowiadać ich budowa chemiczna. W badaniach in vitro obserwowano fototoksyczne działanie ketoprofenu w zakresie stężeń odpowiadającym dawkom ketoprofenu stosowanym klinicznie. Przypuszczalnie wynika ono z działania krótko żyjących wolnych rodników, gdyż in vitro jest w znacznym stopniu hamowane przez dodatek zmiataczy wolnych rodników. Długość fal świetlnych, w obecności których występują reakcje fototoksyczne, leży głównie w zakresie UVA i w pewnym stopniu światła widzialnego. Fototoksyczne działanie ketoprofenu należy brać pod uwagę stosując go w postaci preparatów na skórę – w takim przypadku należy unikać eksponowania skóry na słońce [27, 31].
Aczkolwiek w literaturze opisano wielokrotnie przypadki alergicznego kontaktowego zapalenia skóry wywołanego przez diklofenak, doniesienia o wywołanej przez ten lek reakcji nadwrażliwości na światło są nieliczne i zwykle były konsekwencją długotrwałego stosowania leku i/lub silnej ekspozycji na słońce. Większość z opisanych przypadków dotyczyła stosowania diklofenaku w preparatach do leczenia rogowacenia słonecznego, jedynie pojedyncze przypadki dotyczyły stosowania leku jako przeciwbólowego/przeciwzapalnego [27, 29, 31, 32]. Prospektywne wieloośrodkowe badanie z wykorzystaniem fototestów płatkowych, przeprowadzone wśród pacjentów, którzy zgłosili się z podejrzeniem fotoalergicznego kontaktowego zapalenia skóry potwierdziło, że chociaż diklofenak może być jego przyczyną, to powoduje je bardzo rzadko (w badaniu wzięło udział 1031 osób, w 30 ośrodkach w 12 krajach europejskich) [33].
Tabela 3 NLPZ najczęściej wywołujące reakcje nadwrażliwości na światło słoneczne
| Reakcje fototoksyczne (duża częstość występowania) | Reakcje fotoalergiczne (niewielka częstość występowania) |
| Najczęściej wywoływane przez: Ibuprofen, Ketoprofen, Naproksen, Piroksykam | Najczęściej wywoływane przez: Diklofenak, Etofenemat, Ketoprofen, Piroksykam |
Korzyści ze stosowana diklofenaku miejscowo
Diklofenak stosowany miejscowo w wielu sytuacjach wykazuje skuteczne działanie przeciwbólowe i przeciwzapalne. Głównych korzyści z jego stosowania tą drogą to:
- Skuteczne działanie przeciwbólowe i przeciwzapalne: potwierdzono skuteczność diklofenaku w łagodzeniu bólu o nasileniu od łagodnego do umiarkowanego (£ 4 w numerycznej skali oceny bólu). Ponadto w przypadku urazów, zapaleń stawów i innych schorzeń układu ruchu zmniejsza nasilenie stanu zapalnego w tkankach.
- Działanie bezpośrednio w miejscu aplikacji: aplikacja diklofenaku na skórę pozwala na bezpośrednie dostarczenie leku do rejonu dotkniętego ból lub zapaleniem. Taka metoda stosowania leku może przynieść szybszą ulgę pacjentowi.
- Minimalizacja niepożądanych działań ogólnoustrojowych: podczas ogólnoustrojowego stosowania diklofenaku często występują działania niepożądane, szczególnie w przewodzie pokarmowym, układzie krążenia i nerkach. Stosowanie leku miejscowo pozwala zachować korzyści terapeutyczne, przy minimalnym ryzyku wystąpienia poważnych działań ubocznych.
- Redukcja ryzyka interakcji lekowych: Miejscowe stosowanie diklofenaku ogranicza ryzyko interakcji lekowych, które mogą występować przy jego stosowaniu doustnym.
Środki ostrożności konieczne przy miejscowym stosowaniu diklofenaku [1-7]
Warto podkreślić, że skuteczność i bezpieczeństwo stosowania diklofenaku miejscowo zostały potwierdzone w licznych badaniach klinicznych, co czyni go ważnym narzędziem w terapii bólu i stanów zapalnych. Jednak, podobnie jak w przypadku każdym leku, zaleca się stosowanie go zgodnie z zaleceniami i uwzględnienie indywidualnych cech pacjenta.
- Stosować wyłącznie na nieuszkodzoną, zdrową powierzchnię skóry
- Stosować tylko u osób w wieku > 14 lat (plastry przezskórne > 16 lat)
- Przestrzegać zalecanego maksymalnego czasu stosowania bez konsultacji z lekarzem
- Żel
- W nadwyrężeniach i reumatyzmie tkanek miękkich – do 14 dni
- W chorobie zwyrodnieniowej stawów – 21-28 dni
- W bólu u młodzieży > 14 lat – do 7 dni
- Plastry przezskórne – nie dłużej niż 7 dni
- Aerozol – do 7-8 dni
- Żel
- Przestrzegać zalecanej częstotliwości stosowania
- Żele 1% – zwykle 3-4 razy na dobę
- Żele 2% – zwykle 2 razy na dobę
- Plastry przezskórne – 1 plaster co 12 godzin
- Aerozol – 3 razy na dobę
- Nie przekraczać maksymalnej ilości leku zalecanej do stosowania w ciągu doby. Dostosować ilość preparatu do rozmiarów chorego miejsca.
- Stosować ok. 2 g żelu (ilość wielkości owocu wiśni) – na dłoń, nadgarstek lub łokieć
- Stosować ok. 4 g żelu (ilość wielkości orzecha włoskiego) – na stopę, staw skokowy lub kolano
- Stosować w danym czasie tylko 1 plaster (w danym czasie leczony może być wyłącznie tylko jeden obszar ciała)
- Stosować jednorazowo maksymalnie 5 dawek aerozolu (aplikacji z rozpylacza) i nie więcej niż 15 dawek na dobę
- Nie stosować jednocześnie z diklofenakiem, w tych samych miejscach na skórze
- Kosmetyków, balsamów
- Filtrów przeciwsłonecznych
- Środków nawilżających skórę
- Środków odstraszających owady
- Innych leków stosowanych miejscowo
- Nie stosować na miejsce aplikacji leku szczelnych opatrunków okluzyjnych, nieprzepuszczającymi powietrza (można stosować opatrunek lub bandaż, ale tylko przepuszczający powietrze)
- Dokładnie umyć dłonie (chyba, że dłonie są miejscem leczonym)
- Po aplikacji żelu lub aerozolu
- Po aplikacji, poprawianiu i usuwaniu plastra
- Unikać kontaktu leku z oczami i ustami
- Po zastosowaniu żelu lub aerozolu, aby umożliwić wyschnięcie skóry, odczekać kilka minut przed założeniem odzieży, opatrunku lub bandaża
- Jeżeli dłonie są miejscem leczonym, po zastosowaniu żelu lub aerozolu przez 1 godzinę nie myć rąk
Piśmiennictwo
- Charakterystyka Produktu Leczniczego Olfen Max https://www.olfen.pl/produkty/olfen-max/
- Charakterystyka Produktu Leczniczego Olfen hydrożel https://www.olfen.pl/produkty/olfen-hydrozel/
- Charakterystyka Produktu Leczniczego Voltaren Sport
- Charakterystyka Produktu Leczniczego Voltaren Max
- Charakterystyka Produktu Leczniczego Diky 4%
- Charakterystyka Produktu Leczniczego Itami
- Charakterystyka Produktu Leczniczego Olfen Patch https://www.olfen.pl/produkty/olfen-patch/
- https://indeks.mp.pl/ (dostęp 10.05.2025)
- Atzeni F, Masala IF, Sarzi-Puttini P. A Review of Chronic Musculoskeletal Pain: Central and Peripheral Effects of Diclofenac. Pain Ther. 2018;7(2):163-177.
- Brune K., (2007) Persistence of NSAIDs at effect sites and rapid disappearance from side-effect compartments contributes to tolerability, Current Medical Research and Opinion, 23:12, 2985-2995, DOI: 10.1185/030079907X242584
- Warner TD, Giuliano F, Vojnovic I, Bukasa A, Mitchell JA, Vane JR. Nonsteroid drug selectivities for cyclo-oxygenase-1 rather than cyclo-oxygenase-2 are associated with human gastrointestinal toxicity: a full in vitro analysis. Proc Natl Acad Sci U S A. 1999 Jun 22;96(13):7563-8. doi: 10.1073/pnas.96.13.7563.
- Gan TJ. Diclofenac: an update on its mechanism of action and safety profile. Curr Med Res Opin. 2010 Jul;26(7):1715-31. doi: 10.1185/03007995.2010.486301
- Alves DP, Tatsuo MA, Leite R, Duarte ID. Diclofenac-induced peripheral antinociception is associated with ATP-sensitive K+ channels activation. Life Sci. 2004 Apr 2;74(20):2577-91. doi: 10.1016/j.lfs.2003.10.012.
- Salzer I, Ray S, Schicker K, Boehm S. Nociceptor Signalling through ion Channel Regulation via GPCRs. Int J Mol Sci. 2019 May 20;20(10):2488. doi: 10.3390/ijms20102488.
- Zhou, 2016 Zhou RP, Wu XS, Wang ZS, Xie YY, Ge JF, Chen FH. Novel Insights into Acid-Sensing Ion Channels: Implications for Degenerative Diseases. Aging Dis. 2015 Dec 13;7(4):491-501. doi: 10.14336/AD.2015.1213.
- Pomorska E, Budlewski T, Makowska JS., Zapalenie przyczepów ścięgnistych – tam gdzie zaczyna się spondyloartropatia. Alergia Astma Immunologia 2020, 25 (4): 198-206.
- Hagen M, Baker M. Skin penetration and tissue permeation after topical administration of diclofenac. Curr Med Res Opin. 2017 Sep;33(9):1623-1634. doi: 10.1080/03007995.2017.1352497. Epub 2017 Jul 18.
- Bariguian Revel F, Fayet M, Hagen M. Topical Diclofenac, an Efficacious Treatment for Osteoarthritis: A Narrative Review. Rheumatol Ther. 2020 Jun;7(2):217-236. doi: 10.1007/s40744-020-00196-6. Epub 2020 Feb 21.
- Altman R, Bosch B, Brune K, Patrignani P, Young C. Advances in NSAID development: evolution of diclofenac products using pharmaceutical technology. Drugs. 2015 May;75(8):859-77. doi: 10.1007/s40265-015-0392-z.
- Brunner M, Dehghanyar P, Seigfried B, Martin W, Menke G, Müller M. Favourable dermal penetration of diclofenac after administration to the skin using a novel spray gel formulation. Br J Clin Pharmacol. 2005 Nov;60(5):573-7. doi: 10.1111/j.1365-2125.2005.02484.x.
- Efe T, Sagnak E, Roessler PP, Getgood A, Patzer T, Fuchs-Winkelmann S, Peterlein CD, Schofer MD. Penetration of topical diclofenac sodium 4 % spray gel into the synovial tissue and synovial fluid of the knee: a randomised clinical trial. Knee Surg Sports Traumatol Arthrosc. 2014 Feb;22(2):345-50. doi: 10.1007/s00167-013-2408-0. Epub 2013 Jan 22.
- Zacher J, Altman R, Bellamy N. I wsp., Topical diclofenac and its role in pain and inflammation: an evidence-based review. Curr Med Res Opin. 2008;24(4): 925-950
- Predel HG, Koll R, Pabst H. I wsp., Diclofenac patch for topical treatment of acute impact injuries: a randomised, double blind, placebo controlled, multicentre study. Br J Sports Med. 2004;38(3):318-323
- Varghese E, Khar RK., Enhanced skin permeation of diclofenac by iontophoresis: in vitro and in vivo studies. Journal of Controlled Release 38 (1996) 21-27.
- Akinbo S, Owoeye O, Adesegun S., Comparison of the therapeutic efficacy of diclofenac sodium and methyl salicylate phonophoresis in the management of knee osteoarthritis. Archives of Rheumatology, 2011, 26.2: 111-119.
- Jarit P, Klyve D, Walters R. Long Duration Sonophoresis of Diclofenac to Augment Rehabilitation of Common Musculoskeletal Injuries. Glob J Orthop Res. 2023;4(2):584-588.
- Bagheri H, Lhiaubet V, Montastruc JL, Chouini-Lalanne N. Photosensitivity to ketoprofen: mechanisms and pharmacoepidemiological data. Drug Saf. 2000 May;22(5):339-49. doi: 10.2165/00002018-200022050-00002
- Montgomery, 2022 (tabela) Montgomery S, Worswick S. Photosensitizing drug reactions. Clin Dermatol. 2022 Jan-Feb;40(1):57-63. doi: 10.1016/j.clindermatol.2021.08.014. Epub 2021 Aug 8.
- Jenerowicz D., Jakubowicz O., Polańska A. i wsp., Photosensitivity to selected topical nonsteroidal anti-inflammatory drug preparations – a review of literature data and author’s own experience, Central European Journal of Immunology 2011; 36 (3): 197–203.
- Śpiewak R. Wyprysk fotoalergiczny i fototoksyczny. Alergoprofil 2009; 5: 2-7.
- Becker L, Eberlein-König B, Przybilla B. Phototoxicity of non-steroidal anti-inflammatory drugs: in vitro studies with visible light. Acta Derm Venereol. 1996 Sep;76(5):337-40. doi: 10.2340/0001555576337340
- Kowalzick L, Ziegler H. Photoallergic contact dermatitis from topical diclofenac in Solaraze gel. Contact Dermatitis. 2006 Jun;54(6):348-9. doi: 10.1111/j.0105-1873.2006.0645f.x.
– Kerr, 2012 European Multicentre Photopatch Test Study (EMCPPTS) Taskforce. A European multicentre photopatch test study. Br J Dermatol. 2012 May;166(5):1002-9. doi: 10.1111/j.1365-2133.2012.10857.x.
Autor artykułu
dr n. med. Małgorzata Berezińska
Katedra Farmakologii Ogólnej, Klinicznej i Toksykologii;
Zakład Farmakologii i Toksykologii
Uniwersytet Medyczny w Łodzi
malgorzata.berezinska@umed.lodz.pl